


本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFR T790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗
 中国信达生物制药
中国信达生物制药  用法用量
用法用量 副作用
副作用  注意事项
注意事项  适应症
适应症  药物相互作用
药物相互作用 【药品名称】
通用名称:利厄替尼片
商品名称:奥壹新
英文名称:Limertinib Tablets
汉语拼音:Li‘etini Pian
【成份】
本品活性成份为利厄替尼。
化学名称:N-[5-[[5-氯-4-[(萘-2-基)氨基]嘧啶-2-基]氨基]-2-[2-(二甲氨基)乙基]甲基氨基]-4-甲氧基苯基]丙烯酰胺
化学结构式:
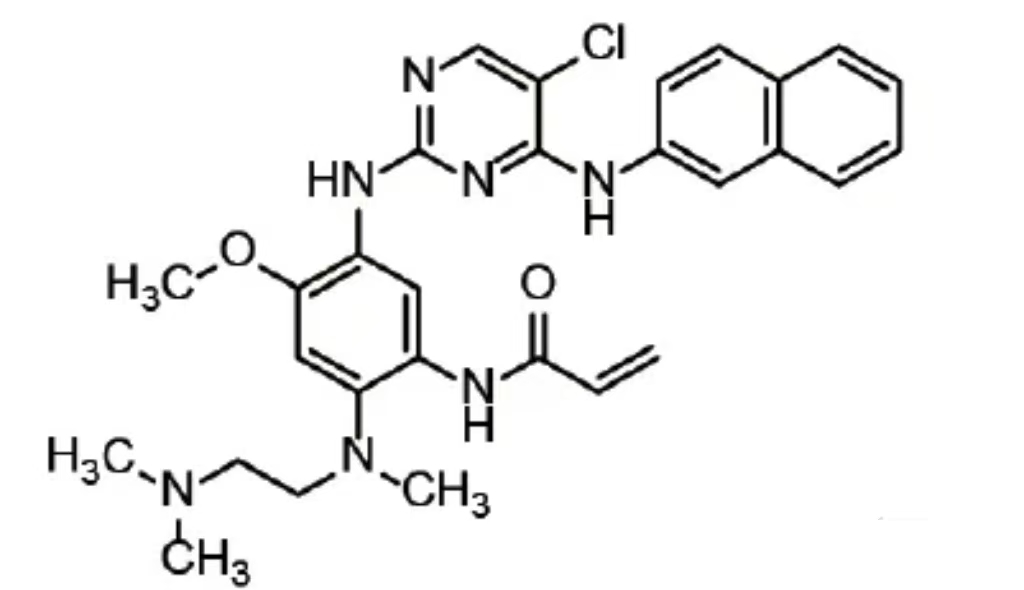
分子式:C29H32CIN7O2
分子量:546.07
辅料:微晶纤维素、甘露醇、交联羧甲基纤维素钠、硬脂富马酸钠、胶态二氧化硅及薄膜包衣预混剂(胃溶型)
【性状】
本品为粉红色薄膜衣片,除去包衣后显白色。
【规格】
80mg
【适应症】
本品适用于既往经表皮生长因子受体(EGFR)酪氨酸激酶抑制剂(TKI)治疗时或治疗后出现疾病进展,并且经检测确认存在EGFRT790M突变阳性的局部晚期或转移性非小细胞肺癌(NSCLC)成人患者的治疗。
【用法用量】
本品应在抗肿瘤治疗方面富有经验的医生指导下使用。
在使用本品治疗局部晚期或转移性NSCLC前,首先需要明确EGFRT790M突变的状态。应采用经批准的检测方法确定存在EGFRT790M突变方可使用本品治疗(详见【注意事项】)。
剂量及给药方法
本品推荐剂量为每次160mg,每日2次,空腹(餐前1小时或餐后2小时)服用,两次时间间隔为12小时,用药至出现疾病进展或发生不可耐受的不良反应。
建议每日大致在同一时间服用,整片吞服,用适量温水送服,不要咀嚼或压碎。如果漏服本品1次,若距离下次服药时间间隔大于6小时,则应补服本品。
剂量调整
本品使用过程中应密切监测不良反应,根据患者个体的安全性和耐受性,可暂停用药、降低剂量或停止本品治疗。如果需要降低剂量,则剂量可减至80mg,每天2次。
发生不良反应后的剂量调整原则详见表1和表2。
应在第一次以及后续任何时间出现稀便时开始抗腹泻药物治疗如洛哌丁胺并按需服用适量等渗液体,并且对于持续腹泻的情况应持续用药至腹泻恢复。
表1.腹泻的管理建议
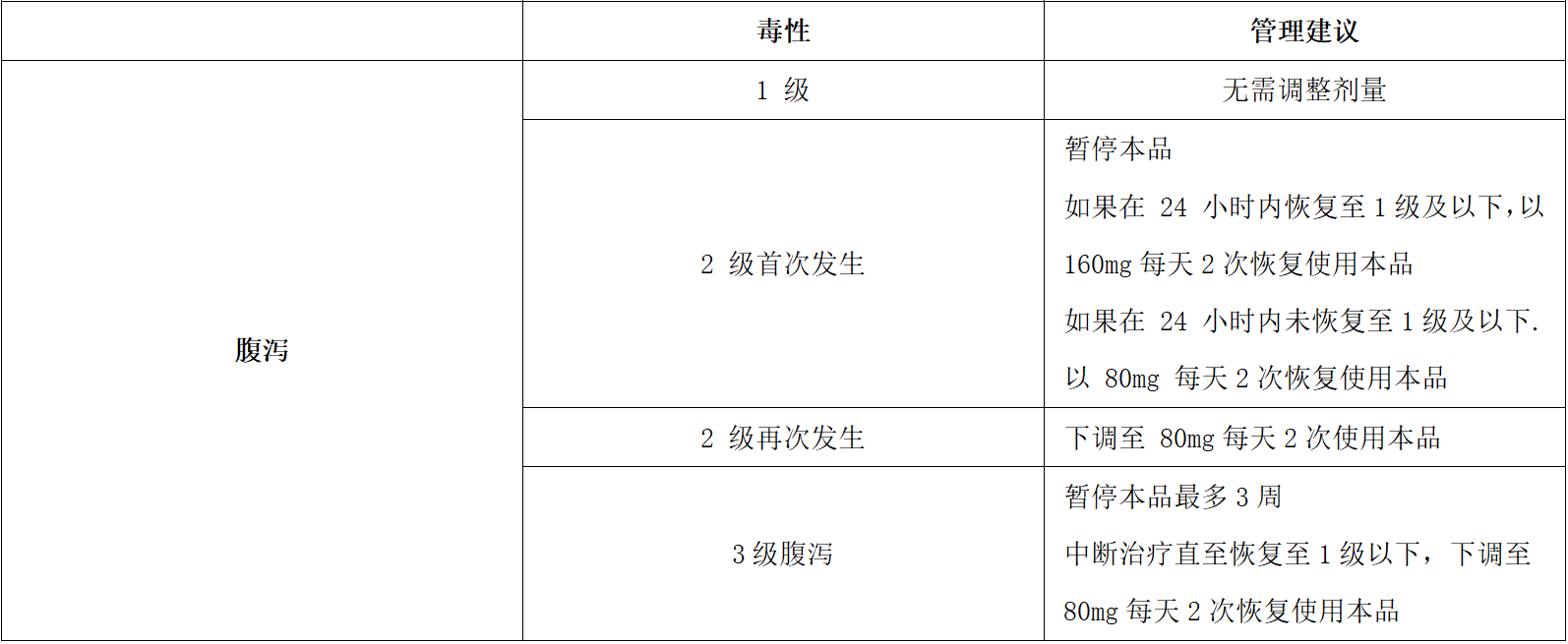
表2.其他毒性的管理建议
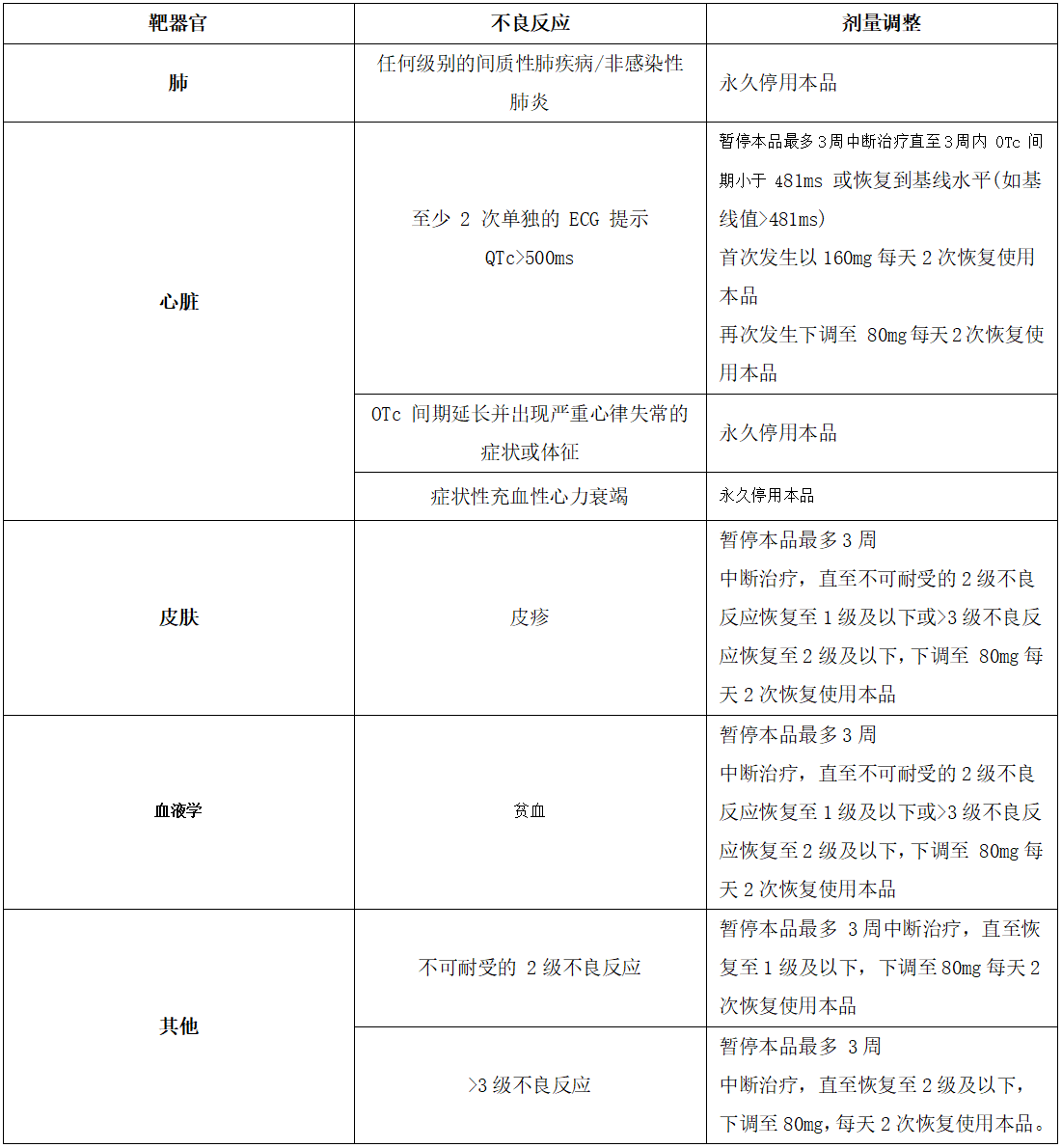
NCI CTC AE4. 03:美国国家癌症研究所常见药物毒性反应分级标准4.03版。
特殊人群
无需根据患者的年龄、体重、性别和吸烟状态进行剂量调整。
肝功能损害
轻度肝功能损害患者无需进行剂量调整。尚未在中重度肝功能损害患者中开展临床试验。中重度肝功能损害患者应慎用本品(见【临床药理】)。
肾功能损害
轻中度肾功能损害患者无需进行剂量调整。尚未在重度肾功能损害患者中开展临床试验。重度肾功能损害患者应慎用本品(见【临床药理】)。
【不良反应】
本说明书描述了在临床试验中观察到的判断为可能由利厄替尼引起的不良反应及其近似的发生率。由于临床试验是在各种不同条件下进行的,在一个临床试验中观察到的不良反应发生率不能与另一个临床试验中观察到的不良反应发生率直接比较,也可能不能反映临床实践中的实际发生率。
· 来自利厄替尼二线治疗Ⅰ/Ⅱ期联合设计临床试验的数据
利厄替尼ASK-LC-120067-Ⅰ/Ⅱ研究是一项开放、单臂、多中心的Ⅰ/Ⅱ期联合设计的多中心临床试验,在既往经EGFR TKI治疗进展的EGFR T790M突变阳性的局部晚期或转移性NSCLC患者中,评价利厄替尼的安全性、有效性和药代动力学特征。该试验中共有366例受试者暴露于利厄替尼日剂量≥320mg剂量水平,其中有359例受试者暴露于160mg(每日两次)剂量水平,包括剂量扩展(Ⅱa期)58例,剂量延伸(Ⅱb期)301例:有3例受试者暴露于320mg(每日一次)剂量水平:有4例受试者暴露于240mg(每日两次)剂量水平。利厄替尼的平均累计暴露时间为9.4个月。
在366例暴露于日剂量≥320mg剂量水平的患者中,24.6%(90例)的患者因不良反应暂停治疗。导致暂停治疗的发生率≥1%的不良反应为腹泻(9.3%)、皮疹(1.9%)、贫血(1.9%)、低钾血症(1.9%)、食欲减退(1.4%)和血小板计数降低(1.4%)。24.9%(91例)的受试者因治疗相关不良反应而减量,导致降低剂量最常见的不良反应为腹泻(13.1%)。4.1%(15例)患者因不良反应而永久停药。
在日剂量≥320mg的剂量水平,发生率≥5%的不良反应包括胃肠系统疾病(腹泻83.3%、恶心30.3%和呕吐24.9%)、代谢及营养类疾病(食欲减退29.8%、低钾血症18.9%、高尿酸血症10.1%、低白蛋白血症9.3%、高甘油三酯血症和高胆固醇血症均为6.0%)、皮肤及皮下组织类疾病(皮疹29.5%和瘙痒6.8%)、贫血(32.5%)、虚弱(13.1%)、蛋白尿(12.0%)和尿路感染(6.0%)。9.6%(35例)的患者发生了严重不良反应,发生率≥1%的严重不良反应为腹泻(1.4%)、食欲减退(1.4%)和低钾血症(1.1%)。
常见的(≥5%)医学检查异常包括体重降低(16.9%)、血肌酐升高(16.4%)、血小板计数降低(13.9%)、白细胞计数降低(12.8%)、潜血阳性(11.2%)、天门冬氨酸氨基转移酶升高(10.7%)、丙氨酸氨基转移酶升高(9.3%)、血肌酸磷酸激酶升高(8.5%)和中性粒细胞计数降低(6.8%)。
ASK-LC-120067-Ⅰ/Ⅱ研究中日剂量≥320mg剂量水平下发生率≥5%的所有级别不良反应及发生率≥1%的3-4级不良反应见表3。
表3.ASK-LC-120067-Ⅰ/Ⅱ研究中接受日剂量≥320mg利厄替尼治疗的常见不良反应
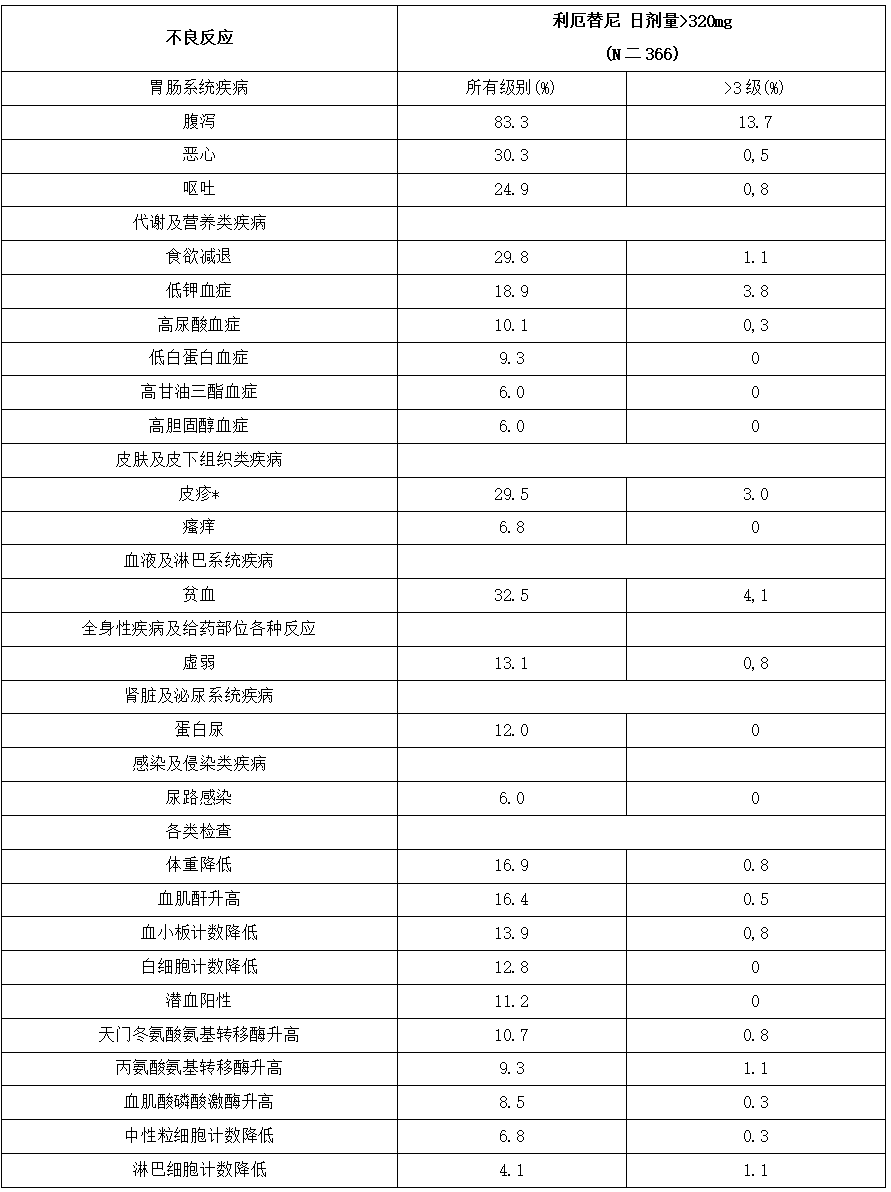
NCI CTC AE 4.03:美国国家癌症研究所常见药物毒性反应分级标准4.03版。
注:*皮疹类事件:包括皮疹、全身皮疹、局部性皮疹、双下肢皮疹、眼周皮疹等。
重要不良反应
腹泻
本品临床试验中,日剂量≥320mg剂量水平305例(83.3%)发生腹泻,其中3级及以上有50例(13.7%)。有34例(9.3%)患者暂停治疗,48例(13.1%)患者进行了减量治疗,2例(0.5%)患者永久停药,从开始服药至首次发生腹泻的中位时间为5天,中位持续时间为2天。(见【注意事项】)。
皮疹
本品临床试验中,日剂量≥320mg剂量水平108例(29.5%)发生皮疹,大部分的严重程度为1-2级,3级有11例(3%)。有7例(1.9%)患者暂停治疗,6例(1.6%)患者进行了减量治疗,无患者因皮疹永久停药。从开始服药至首次发生皮疹的中位时间为17天,中位持续时间为12天。(见【注意事项】)。
间质性肺病(ILD)
本品临床试验中,日剂量≥320mg剂量水平发生间质性肺病(ILD)2(0.6%)例,均为CTCAE2级,发生时间均在治疗后120天以上,2例患者经治疗后均已改善或痊愈,无死亡事件(见【注意事项】)。
QTc间期延长
本品临床试验中,日剂量≥320mg剂量水平有2例(0.5%)患者在用药期间出现QTc间期延长超过500ms或较基线延长超过60ms,其中1例患者上述两种情况同时存在。2例均暂停本品治疗,其中1例进行了减量治疗。临床试验中未出现尖端扭转型室性心动过速、阵发性室性心动等危及生命的心律失常(见【注意事项】)。
心肌收缩力改变
本品临床试验中,日剂量≥320mg剂量水平有1例(0.3%)受试者在用药期间出现左室射血分数(LVEF)绝对值较基线下降>10%(绝对值为57%),未改变研究药物治疗下自行恢复(见【注意事项】)。
眼部疾病
本品临床试验中,日剂量≥320mg剂量水平共发生各类眼器官疾病10例(2.7%),包括视物模糊、干眼症、眼睑水肿、流泪增加等,均为CTCAE1-2级,均未改变研究药物治疗。未发生因角膜溃疡导致永久停药(见【注意事项】)。
贫血
本品临床试验中,日剂量≥320mg剂量水平119例(32.5%)患者发生贫血,大部分的严重程度为1-2级,其余均为3级15例(4.1%)。有7例(1.9%)患者暂停治疗,2例(0.5%)患者进行了减量治疗。从首次给药至贫血发生的中位时间为42天,中位持续时间为55天。无患者因贫血永久停药(见【注意事项】)。
【禁忌】
对本品任何成份过敏者禁用。
【注意事项】
EGFR T790M状态的确认
当考虑使用本品治疗局部晚期或转移性NSCLC时,首先需要明确EGFRT790M突变的状态。应采用经批准的检测方法对采自肿瘤组织样本的DNA或血浆样本中获取的循环肿瘤DNA(ctDNA)进行检测。
通过组织或血浆检测后,如果EGFRT790M突变状态为阳性,提示可使用本品治疗。如果使用的是血浆ctDNA检测,且结果为阴性,建议在可能的情况下应再进行肿瘤组织检测,这是由于血浆检测可能会出现假阴性结果。
腹泻
对于在用药过程中出现腹泻,或用药前已有腹泻而治疗后腹泻加重者,均应考虑治疗相关腹泻的可能性。腹泻发生时,在确立本品所致腹泻时,应同时排除或鉴别其他原因导致的腹泻,如肠道菌群紊乱、免疫功能低下导致肠道病原微生物感染等。由于会影响到后续本品的治疗策略,排除其他原因导致的腹泻至关重要。
一旦诊断为本品所致腹泻,应对腹泻进行合理评估,了解腹泻的严重程度。治疗上应避免脱水,改变饮食,使用止泻药物(盐酸洛哌丁胺、蒙脱石散等),若合并感染,则考虑给予预防性抗生素治疗。本品160mg(每日两次)剂量水平下,腹泻为十分常见的不良反应。首次腹泻2级(4-6次/日)持续时间超过24小时或再次腹泻2级或首次腹泻3级(≥7次/日)需降低本品至80mg(每日两次)治疗。进行剂量下调后腹泻发生率明显下降。在剂量延伸(Ⅱb期)87例降低剂量至80mg(每日两次)剂量水平的患者中发生3级及以上腹泻仅有4例(4.6%)。具体剂量调整参照表1进行。
腹泻期间可能会出现电解质紊乱,需注意电解质的检测,如果出现电解质紊乱及明显脱水表现,建议医院就诊。
皮疹
在接受利厄替尼治疗的患者中已经报告了皮疹/瘙痒(见【不良反应】)。11例患者(3%)报告3级皮疹,无患者报告3级瘙痒。6例患者因皮疹减量治疗,无患者因皮疹永久停药。对皮肤相关不良反应进行早期预防和干预,如使用防晒霜、使用润肤剂保持皮肤的清洁与湿润、外用2.5%氢化可的松霜剂及抗生素、伴有瘙痒时酌情使用一代或二代抗过敏药等有利于持续进行利厄替尼治疗。
建议患者在使用过程中密切关注是否有新的或恶化的皮肤反应,并在医师的指导下进行对症治疗。若皮肤毒性不能耐受或重度,需停用本品。对于在3周内改善或恢复皮肤毒性的患者,建议以80mg(每日两次)恢复本品治疗。
间质性肺病(ILD)
本品临床试验中,排除了既往存在ILD病史、药物诱导性ILD、需要类固醇激素治疗的放射性肺炎及临床存在活动性ILD证据的患者,无此类患者使用本品的数据。接受本品治疗出现了ILD的患者,经停药、糖皮质激素等治疗后,已好转或痊愈。
对于用药过程中出现呼吸道症状(如呼吸困难、咳嗽或发热等)急性发作或影像学检查异常怀疑ILD,应暂停使用本品。推荐给予全面的诊断性检查如高分辨率CT、血液学和血(痰)培养检查,以排除其他诊断,如癌性淋巴管炎、肺出血、感染、心源性水肿等。如果确诊为ILD,则应永久停用本品,并采取相应的治疗措施。
QTc间期延长
本品临床试验中排除了心脏节律或传导方面有临床显著异常的患者(如QTc间期>470ms)。患有先天性长QT间期综合征的患者应避免使用本品。患有充血性心力衰竭、电解质异常或使用已知能够延长QT间期药物的患者应定期接受心电图和电解质的监测。至少两次独立心电图检测提示QTc间期均值>500ms的患者应进行剂量调整(参见表2)。QTc间期延长合并下列任何一种情况的患者需永久停用本品:尖端扭转性室性心动过速、多形性室性心动过速或严重心律失常的症状或体征。
心肌收缩力改变
对于有已知心血管风险及存在可能影响LVEF情况的患者,需要考虑监测心脏功能。包括在服药前和服药期间测定LVEF。对于本品治疗期间出现心脏事件相关症状和体征的患者,需考虑心脏监测包括LVEF测定。
贫血
接受本品160mg(每日两次)剂量水平治疗的患者发生贫血的中位时间为42天,中位持续时间为55天,2例患者因贫血减量治疗,无患者因贫血永久停药(详见【不良反应】)。出现贫血的患者应根据严重程度级别,在医师的指导下进行监测和对症治疗。
对驾驶和操纵机器能力的影响
本品对驾驶和操作机器能力影响的研究尚未开展。由于可能出现乏力和头晕等不良反应,建议患者在服用本品期间驾驶或操作机器应谨慎。
【孕妇及哺乳期妇女用药】
避孕
育龄期男/女性服用本品期间应避免生育,育龄期女性在接受本品治疗期间和治疗结束至少3个月应采取有效的避孕措施,男性为6个月。
妊娠
尚无妊娠期妇女服用本品的研究资料。
根据临床前数据,妊娠女性使用本品时可能会对胎儿造成危害,如在使用过程中发现妊娠,建议停用本品并于妇产科就诊。
哺乳
尚无哺乳期妇女服用本品的资料。尚不清楚本品和/或其代谢产物是否会通过人的乳汁排泄,无法排除本品对受乳的婴儿会产生影响。因此,采用本品治疗期间应停止哺乳。
【儿童用药】
目前尚无18周岁以下患者应用本品的安全性和有效性资料。
【老年用药】
本品临床试验中,接受利厄替尼日剂量≥320mg治疗的366例患者中,137例(37.4%)≥65岁。65岁及以上患者的不良反应发生率为96.4%(所有年龄患者的发生率为96.4%),其中3级及以上不良反应的发生率为43.8%(所有年龄患者的发生率为34.7%);导致暂停用药不良反应发生率为32.1%(所有年龄患者的发生率为24.6%),导致剂量减少的不良反应发生率为27.0%(所有年龄患者的发生率为24.9%),导致永久停药的不良反应发生率为5.8%(所有年龄患者的发生率为4.1%)。目前的临床试验数据表明,老年患者的安全性特征与总体人群无明显差异,在医生指导下使用时无需进行剂量调整。
【药物相互作用】
CYP3A强效抑制剂
在健康志愿者中与单独给药相比,本品与CYP3A强效抑制剂伊曲康唑合用,可导致利厄替尼暴露量显著升高(见【临床药理】)。本品应避免与CYP3A强效抑制剂合用。
CYP3A强效诱导剂
在健康志愿者中与单独给药相比,本品与CYP3A强效诱导剂利福平合用,可导致利厄替尼暴露量显著降低(见【临床药理】)。本品应避免与CYP3A强效诱导剂合用。
体外研究提示,利厄替尼主要由CYP3A4介导代谢,本品联用其他CYP3A4的抑制剂或诱导剂时应当谨慎。体外研究提示,利厄替尼可以浓度依赖性抑制外排转运体BCRP和MDR1。合并服用本品可能会发生因为抑制肠道BCRP和MDR1的活性而导致BCRP和MDR1底物暴露量的增加。
【药物过量】
在Ⅰ/Ⅱ期临床研究中,有4例患者每日服用利厄替尼的剂量达到480mg,其中2例受试者观察到3级腹泻。
本品过量后,尚没有特殊的治疗。在使用本品的过程中,一旦发生药物过量,需立即暂停用药,对患者进行密切监测,并根据临床需要采取合理的对症治疗。
【临床药理】
作用机制
参见【药理毒理】相关内容。
药效学
本品尚无生物标志物或其它临床相关参数影响的药效动力学数据。
心脏电生理学
尚未进行QT/QTc间期延长临床研究,但目前临床研究数据未发现利厄替尼有QT间期延长的风险。
药代动力学
在NSCLC患者中单次空腹给药40-320mg的剂量后,其血浆表观清除率约为7.303-12.928L/h,表观分布容积约为162.8-229.3L,终末半衰期约为12.105-19.947h;在40-320mg的剂量范围内,本品的AUC和Cmax与剂量基本成正比。利厄替尼每日两次口服5天后达到稳态,暴露蓄积比约为2倍。
吸收
NSCLC患者单次口服利厄替尼后,利厄替尼的血浆峰浓度的中位达峰时间为2.02-3.50h。基于一项以160mg剂量在中国健康受试者中进行的临床药代动力学研究,高脂饮食会提高本品的生物利用度:AUC增加45.39%(90%CI:128.14,164.96),Cmax增加45.45%(90%CI:117.25,180.44),达峰时间大约延长1.25h。
分布
利厄替尼在40-320mg的剂量下每天1次给药后,稳态分布容积Vss/F均值为222.823-339.625L,提示药物在组织内有广泛分布。体外研究显示,利厄替尼与人血浆蛋白的结合率大于99.5%(3个不同浓度下,蛋白结合率在99.51%-99.67%),为高蛋白结合药物。
代谢
体外研究提示,利厄替尼主要通过CYP3A4代谢。[14C]利厄替尼人体物质平衡研究结果表明,血浆中最主要放射性成分为原形药利厄替尼,占血浆总放射性暴露量的31.35%。除原形药物之外,鉴定的血浆中主要代谢产物为N-脱烷基代谢物(M474),占血浆总放射性暴露量的7.92%,活性代谢产物CCB4580030仅为总暴露量的2.32%。利厄替尼的主要代谢通路为去甲基和脱烷基化,此外还有氧化、水解、硫酸酯化和半胱氨酸结合等途径。在人体的血浆、尿液和粪便的汇总样品中共鉴定出了14个主要代谢物成分。
排泄
男性健康志愿者单次口服160mg/50μCi的[14C]利厄替尼混悬液后,从尿液和粪便中回收的总放射性占总给药量的84.80%±1.50%,其中粪便回收的占总给药量的76.40%±1.25%,从尿液中回收的占总给药量的8.39%±0.79%,提示利厄替尼主要通过粪便途径排泄,少量通过尿液排泄。
特殊人群药代动力学
本品尚无单独在肝功能损害患者、肾功能损害患者、儿科人群的药代动力学研究数据。
肝功能损害
本品在肝功能损害患者应用数据有限。群体药代动力学分析显示,轻度肝功能损害不影响本品体内暴露量。尚无中重度肝功能损害患者服用本品的临床试验数据。
肾功能损害
本品在肾功能损害患者应用数据有限。群体药代动力学分析显示,轻中度肾功能损害不影响本品体内暴露量。尚无重度肾功能损害患者服用本品的临床试验数据。
人体药代动力学相互作用
CYP3A强抑制剂
利厄替尼与CYP3A强抑制剂伊曲康唑联合用药时,血浆中利厄替尼的AUC0-∞升高289.80%,Cmax升高89.65%;活性代谢物CCB4580030的AUC0-∞降低35.96%,Cmax降低75.28%。
CYP3A强诱导剂
利厄替尼与CYP3A强诱导剂利福平联合用药时,血浆中利厄替尼的AUC0-∞降低87.86%,Cmax降低73.44%;活性代谢物CCB4580030的AUC0-∞降低66.82%,Cmax降低19.76%。
【临床试验】
既往接受过治疗的EGFR T790M突变阳性的局部晚期或转移性NSCLC患者-ASK-LC-120067-Ⅰ/Ⅱ研究
ASK-LC-120067-Ⅰ/Ⅱ临床试验的Ilb期阶段共入组301例经第一/二代EGFRTKI治疗后进展并伴有EGFR T790M突变阳性的、不可手术切除的局部晚期或转移性NSCLC患者,接受利厄替尼160mg每日两次治疗,直至疾病进展或出现不能耐受的毒性反应。研究主要终点为经独立评审委员会(IRC)评估的客观缓解率(ORR),次要终点包括研究者评估的ORR、疾病控制率(DCR)、缓解持续时间(DoR)、无进展生存期(PFS)、总生存期(OS)、安全性等。
301例患者的基线人口学和疾病特征为:中位年龄60岁(范围33-83岁);男性37.9%、女性62.1%:77.3%从不吸烟,22.7%既往或正在吸烟:13.3%为ECOG评分0分,81.1%为1分,5.6%为2分;34.6%为ⅣA期,62.5%为ⅣB期;98.3%为腺癌,0.6%为鳞癌或腺鳞癌;所有患者均具有EGFR T790M突变。此外,61.1%的患者具有EGFR19外显子缺失突变,33.2%具有EGFR L858R突变;32.9%的患者存在中枢神经系统(CNS)转移。该研究的中位PFS随访时间为18.0个月。
总体有效性结果
利厄替尼Ⅱb期研究主要终点IRC评估的ORR为68.8%(95%Cl:63.2,74.0),次要终点DCR、PFS、DoR。
CNS转移人群的有效性结果
利厄替尼Ⅱb期研究允许纳入无症状、病情稳定、研究治疗开始前4周内不需要类固醇药物治疗的CNS转移患者。基于RECISTv1.1标准,41例颅内存在可评估病灶的患者,IRC评估的最佳ORR为65.9%(95%CI:49.4.79.9),mDoR为7.8个月:经确认的ORR为56.1%(95%Cl:39.7,71.5),mDoR为9.3个月;mPFS为10.6个月。
ASK-LC-120067-F-Ⅲ研究是一项随机、双盲、阳性药物为对照的多中心Ⅲ期临床试验,在既往未接受过系统治疗的EGFR敏感突变阳性的局部晚期或转移性NSCLC患者中,评价利厄替尼(80mg,每天两次)对比吉非替尼(250mg,每天一次)的有效性和安全性。目前该研究已完成受试者入组并达成主要终点。
【药理毒理】
药理作用
利厄替尼是表皮生长因子受体(EGFR)激酶抑制剂,对EGFRL858R/T790M耐药突变具有不可逆的抑制作用。IC50较野生型低约20倍。对EGFR T790M突变具有不可逆的抑制作用,IC50较野生型低约12倍。
动物异种移植瘤模型中,利厄替尼对EGFR敏感突变(EGFRexon19Del)或耐药突变(L858R/T790M、EGFR exon19Del/T790M)的肿瘤生长有抑制作用。对EGFR野生型肿瘤生长的抑制作用较弱。
毒理研究
遗传毒性:利厄替尼Ames试验、中国仓鼠肺细胞染色体畸变试验和小鼠体内微核试验结果均为阴性。
生殖毒性:尚未开展专门的生育力及早期胚胎发育毒性试验。一般毒理学试验中未见对动物生殖器官的影响。
大鼠胚胎-胎仔发育毒性试验中,妊娠大鼠于器官发生期妊娠第6-15天(GD6-GD15)经口给予利厄替尼5、15和50mg/kg(根据体表面积计算,约为临床推荐剂量160mg bid的0.15、0.45、1.5倍),50mg/kg组可见吸收胎轻微增加,胎盘重量减轻,胎仔重量减轻、顶臀长减短,骨骼发育延迟、变异或畸形。
致癌性:利厄替尼尚未开展致癌性研究。
【贮藏】不超过30℃保存。请将本品放在儿童不能接触的地方。
【包装】聚酰胺/铝/聚氯乙烯冷冲压成型固体药用复合硬片,药品包装用铝箔,12片/板,2板/盒;10片/板,2板/盒。
【有效期】36个月